La oxigenoterapia hiperbárica aumenta la longitud de los telómeros y disminuye la inmunosenescencia en células sanguíneas aisladas: un ensayo prospectivo orientado a revertir el proceso de envejecimiento.
Traducción del ensayo publicado en la revista Aging.
Introducción
El envejecimiento de la piel puede caracterizarse por la pérdida progresiva de la integridad fisiológica, lo que resulta en funciones deterioradas y susceptibilidad a enfermedades y muerte. Este deterioro biológico se considera un factor de riesgo importante de cáncer, enfermedades cardiovasculares, diabetes y enfermedad de Alzheimer entre otras. A nivel celular, hay dos características clave del proceso de envejecimiento: acortamiento de la longitud de los telómeros y senescencia celular [ 1 ].
Los telómeros son repeticiones de nucleótidos en tándem ubicadas al final de los cromosomas que mantienen la estabilidad genómica. Los telómeros se acortan durante la replicación (mitosis) debido a la incapacidad inherente de replicar completamente la parte final de la hebra de ADN rezagada [ 2 ]. La longitud de los telómeros (TL), que mide entre 4 y 15 kilobases, se acorta gradualmente en ~ 20-40 bases por año y se asocia con diferentes enfermedades, bajo rendimiento físico y adelgazamiento cortical del cerebro [ 3 – 5 ]. Cuando la TL alcanza una longitud crítica, las células no pueden replicarse y progresar hasta la senescencia o la muerte celular programada [ 6 ]. Goglin y col. demostraron que los adultos con LT más cortos tienen mayores tasas de mortalidad [ 7]. Los LT acortados pueden ser un rasgo hereditario directo, pero varios factores ambientales también se han asociado con el acortamiento de LT, incluido el estrés, la falta de actividad de resistencia física, el índice de masa corporal excesivo, el tabaquismo, la inflamación crónica, la deficiencia de vitaminas y el estrés oxidativo [ 2 , 8 , 9 ].
La senescencia celular es una detención del ciclo celular que puede ser causada por el acortamiento de los telómeros [ 10 ], así como por otros estímulos asociados al envejecimiento independientes de TL, como el daño del ADN no telomérico [ 1 ]. El propósito principal de la senescencia es prevenir la propagación de las células dañadas activando su eliminación a través del sistema inmunológico. La acumulación de células senescentes con el envejecimiento refleja un aumento en la generación de estas células y / o una disminución en su depuración, lo que a su vez agrava el daño y contribuye al envejecimiento [ 1 ].
Un creciente cuerpo de investigación ha encontrado varios agentes farmacológicos que pueden reducir la tasa de acortamiento de los telómeros [ 11 , 12 ]. Varias intervenciones en el estilo de vida, incluido el entrenamiento de resistencia, dietas y suplementos dirigidos al metabolismo celular y al estrés oxidativo, han informado efectos relativamente pequeños (2-5%) sobre TL 3, [ 2 , 8 , 9 ].
La terapia de oxígeno hiperbárico (TOHB) utiliza oxígeno al 100% en una presión ambiental superior a una atmósfera absoluta (ATA) para mejorar la cantidad de oxígeno disuelto en los tejidos del cuerpo. Las exposiciones hiperóxicas intermitentes repetidas, usando ciertos protocolos de TOHB, pueden inducir efectos fisiológicos que normalmente ocurren durante la hipoxia en un ambiente hiperóxico, la llamada paradoja hiperóxica-hipóxica [ 13 – 16 ]. Además, recientemente se demostró que TOHB puede inducir mejoras cognitivas en adultos sanos que envejecen a través de mecanismos que implican cambios regionales en el flujo sanguíneo cerebral [ 17]. A nivel celular, se demostró que TOHB puede inducir la expresión del factor inducido por hipoxia (HIF), factor de crecimiento endotelial vascular (VEGF) y sirtuína (SIRT), proliferación de células madre, biogénesis mitocondrial, angiogénesis y neurogénesis [ 18 ]. Sin embargo, ningún estudio hasta la fecha ha examinado los efectos del TOHB sobre la TL y la acumulación de células senescentes.
El objetivo del presente estudio fue evaluar si el TOHB afecta la TL y la población de células T similares a la senescencia en adultos mayores.
Resultados
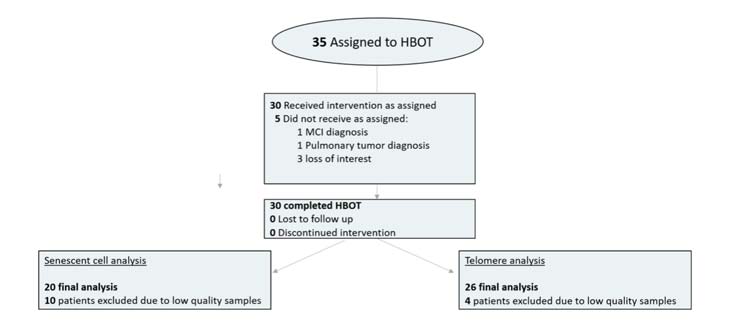
Treinta y cinco personas fueron asignadas a TOHB. Cinco pacientes no completaron las evaluaciones iniciales y fueron excluidos. Los 30 pacientes que completaron las evaluaciones iniciales completaron las intervenciones. Debido a la baja calidad de las muestras de sangre (bajo número de células o error técnico), cuatro pacientes fueron excluidos del análisis de telómeros y 10 pacientes del análisis de células senescentes ( Figura 1 ). Las características basales y la comparación de las cohortes después de la exclusión de los pacientes se proporcionan en la Tabla 1 . No hubo diferencias significativas entre los tres grupos ( Tabla 1 ).
Tabla 1. Características basales.
| TOH | Análisis de telómeros | Análisis senescente | Valor p | ||
| norte | 30 | 25 (83.3%) | 20 (66.6%) | ||
| Años de edad) | 68.41±13.2 | 67.56±14.35 | 66.70±16.00 | 0.917 | |
| IMC | 26.77±3.20 | 26.89±3.34 | 27.14±3.81 | 0.946 | |
| Males | 16 (53.3%) | 13 (52.0%) | 10 (50.0%) | 0.987 | |
| Hembras | 14 (47.7%) | 12 (48.0%) | 10 (50.0%) | 0.987 | |
| Hemograma completo | |||||
| Hemoglobina | 6.33±1.25 | 6.57±1.15 | 6.58±1.29 | 0.707 | |
| células blancas de la sangre | 14.02±1.40 | 13.92±1.35 | 13.97±1.49 | 0.969 | |
| % PBMC | 39.96±6.75 | 39.25±6.64 | 38.59±6.63 | 0.774 | |
| Plaquetas | 239.87±1.39 | 244.08±43.0 | 254.05±41.4 | 0.559 | |
| Condiciones médicas crónicas | |||||
| Fibrilación auricular | 4 (13.3%) | 4 (16.0%) | 2 (10.0%) | 0.841 | |
| Hipotiroidismo | 4 (13.3%) | 4 (16.0%) | 3 (15.8%) | 0.956 | |
| Apnea obstructiva del sueño | 4 (13.3%) | 4 (16.0%) | 3 (15.0%) | 0.961 | |
| Asma | 1 (3.3%) | 1 (4.0%) | 0 | 0.680 | |
| HPB | 7 (23.3%) | 5 (20.0%) | 6 (30.0%) | 0.733 | |
| ERGE | 3 (10%) | 2 (8.0%) | 2 (10.0%) | 0.961 | |
| Osteoporosis | 5 (16.7%) | 5 (20.0%) | 4 (20.0%) | 0.936 | |
| Artritis reumática | 1 (3.3%) | 0 | 1 (5.0%) | 0.561 | |
| Osteoartritis | 7 (23.3%) | 4 (16.0%) | 5 (25.0%) | 0.755 | |
| Diabetes mellitus | 3 (10%) | 3 (12.0%) | 2 (10.0%) | 0.966 | |
| Hipertensión | 7 (23.3%) | 5 (20.0%) | 5 (25.0%) | 0.918 | |
| Dislipidemia | 16 (53.3%) | 14 (56.0%) | 12 (60.0%) | 0.897 | |
| Enfermedad isquémica del corazón | 2 (6.7%) | 1 (4.0%) | 2 (10.0%) | 0.725 | |
| Historia de tabaquismo | 10 (33.3%) | 8 (32.0%) | 7 (35.0%) | 0.978 | |
| Medicamentos crónicos | |||||
| Antiagregación | 8 (26.7%) | 6 (24.0%) | 5 (25.0%) | 0.974 | |
| Inhibidores de la ECA / bloqueadores ARB | 6 (20%) | 6 (24.0%) | 6 (30.0%) | 0.720 | |
| Bloqueadores beta | 5 (16.7%) | 5 (20.0%) | 3 (15.0%) | 0.901 | |
| Bloqueadores de calcio | 3 (10%) | 3 (12.0%) | 2 (10.0%) | 0.966 | |
| Bloqueadores alfa | 7 (23.3%) | 5 (20.0%) | 6 (30.0%) | 0.733 | |
| Diuréticos | 2 (6.7%) | 1 (4.0%) | 1 (5.0%) | 0.906 | |
| Estatinas | 10 (33.3%) | 9 (36.0%) | 7 (35.0%) | 0.978 | |
| Hipoglucemiante oral | 1 (3.3%) | 1 (4.0%) | 1 (5.0%) | 0.958 | |
| Bisfosfonatos | 1 (3.3%) | 1 (4.0%) | 1 (5.0%) | 0.958 | |
| Inhibidores de la bomba de protones | 3 (10%) | 3 (12.0%) | 3 (15.0%) | 0.726 | |
| Hormonas | 3 (10%) | 3 (12.0%) | 2 (10.0%) | 0.966 | |
| Benzodiazepinas | 3 (10%) | 2 (8.0%) | 1 (5.0%) | 0.816 | |
| ISRS | 5 (16.7%) | 5 (20.0%) | 3 (15.0%) | 0.990 |
Longitud del telómero
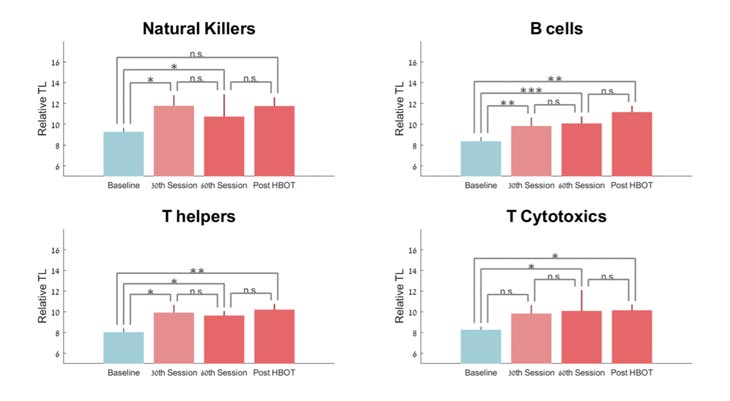
En comparación con la línea de base, las longitudes de los telómeros T-helper aumentaron significativamente en el 30 º sesión y post-TOH por 21,70 ± 40,05 (p = 0,042), 23,69% ± 39,54 (p = 0,012) y 29,30 ± 38,51 (p = 0,005 ), respectivamente ( Figura 2 ). Sin embargo, el análisis de medidas repetidas muestra una tendencia no significativa (F = 4.663, p = 0.06, Tabla 2 y Figura 2 ).
Figura 2. Cambios en la longitud de los telómeros con TOHB. Media + SEM * p <0,05, ** p <0,01, *** p <0,001.
Tabla 2. Longitud de los telómeros y cambios en las células senescentes post-TOHB.
| Cambios absolutos | Cambios relativos (%) | Medidas repetidas F (p) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PBMC | Base | 30 ª Sesión | 60 ª Sesión | Publicar TOH | 30 º período de sesiones | 60 º período de sesiones | Post-TOHB | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PBMC ((N = 25) | 2.55±0.53 | -0.15±0.40 | -4.91±16.70 | 1,987 (t) 0,09 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PBMC (N = 20) | 2.50±0.53 | -0.13±0.31 | -4.21±11.99 | 1.810 (t) 0.07 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Longitud relativa de los telómeros (N = 25) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Asesino natural | 9.27±1.91 | 11.77±5.14 (0.045) | 10.73±2.73 (0.013) | 11.75±4.22 (0.06) | 25.02±51.42 | 20.56±33.35 | 22.16±44.81 | 0.812 (0.391) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Células B | 8.36±2.02 | 10.22±3.04 (0.007) | 11.23±3.58 (0.0001) | 11.17±2.98 (0.007) | 25.68±40.42 | 29.39±23.39 | 37.63±52.73 | 7.390 (0.017) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ayudante T | 8.04±1.82 | 9.92±3.68 (0.042) | 9.63±2.17 (0.012) | 10.20±2.77 (0.005) | 21.70±40.05 | 23.69±39.54 | 29.30±38.51 | 4.663 (0.063) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T citotóxico | 8.26±1.54 | 9.83±4.08 (0.11) | 10.08±3.33 (0.019) | 10.15±2.74 (0.023) | 18.29±45.62 | 24.13±40.88 | 19.59±33.98 | 1.159 (0.310) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Células senescentes (% de células T) (N = 20) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ayudante T | 10.29±5.42 | 7.84±7.09 (0.09) | 8.51±7.45 (0.20) | 6,22 ± 4,88 (< 0,0001 ) | -19.66±80.03 | -11.67±94.30 | -37.30±33.04 | 8.548 (0.01) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T citotóxico | 52.19±21.07 | 45,53 ± 19,91 (< 0,0001 ) | 45.45±18.81 (0.002) | 46.59±21.91 (0.0004) | -12.21±8.74 | -9.81±9.50 | -10.96±12.59 | 6.916 (0.018) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores de p mostrados en () comparados con la línea de base. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores p en negrita <0,05. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
En comparación con la línea de base, las longitudes de los telómeros de las células B aumentaron significativamente en el 30 º período de sesiones, 60 ª sesión y post-TOH por 25,68% ± 40,42 (p = 0,007), 29,39% ± 23,39 (p = 0,0001) y 37,63% ± 52,73 ( p = 0,007), respectivamente ( Figura 2 ). El análisis de medidas repetidas muestra un efecto significativo dentro del grupo (F = 0.390, p = 0.017, Tabla 2 y Figura 2 ).
En comparación con la línea de base, las longitudes de los telómeros de las células asesinas naturales aumentaron significativamente en la 30ª sesión (p = 0,045) y en la 60ª sesión en un 20,56% ± 33,35 (p = 0,013). Después de TOHB, la longitud de los telómeros aumentó en un 22,16% ± 44,81 después de TOHB (p = 0,06, Tabla 2 y Figura 2 ). El análisis de medidas repetidas indica que no hubo ningún efecto significativo adicional después de la 30ª sesión (F = 0,812, p = 0,391).
En comparación con la línea de base, las células T citotóxicas tenían un aumento no significativo en el 30 º período de sesiones por 18,29% ± 45,62 (p = 0,11), seguido por un aumento significativo de 24,13% ± 40,88 en el 60 º período de sesiones (p = 0,0019) y 19,59% ± 33,98 post-TOHB (p = 0,023). El análisis de medidas repetidas indica que no hubo ningún efecto significativo adicional después de la 30ª sesión (F = 1,159, p = 0,310, Tabla 2 y Figura 2 ).
Células senescentes
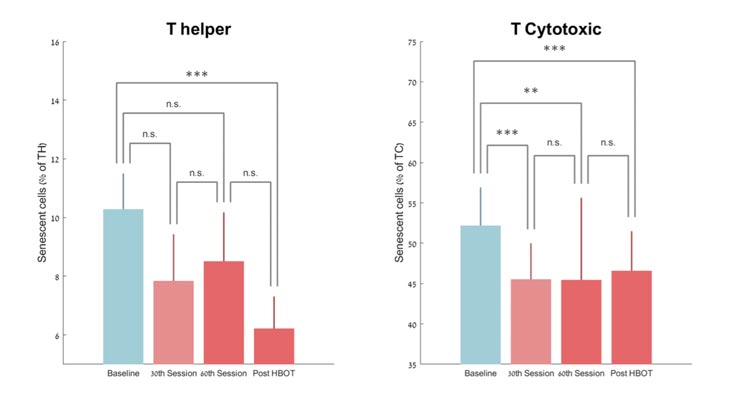
Hubo una disminución no significativa en el número de senescentes T-ayudantes en el 30 º período de sesiones y 60 º período de sesiones por -19,66% ± 80,03 (p = 0,09) y -11,67% ± 94,30 (p = 0,20), respectivamente. Sin embargo, hubo una caída significativa en el número de ayudantes T senescentes en -37,30% ± 33,04 post-TOHB (P <0,0001, Figura 3 ). El análisis de medidas repetidas mostró un efecto continuo significativo incluso después de la 30ª sesión, con un efecto dentro del grupo (F = 8.547, p = 0.01, Tabla 2 y Figura 3 ).
Figura 3. Cambios en las células senescentes con TOHB. Media + SEM * p <0,05, ** p <0,01, *** p <0,001.
Porcentajes de células senescentes T citotóxicas disminuyeron significativamente por -12,21% ± 8,74 (P <0,0001) en el 30 º sesión TOHB, -9,81% ± 9,50 en el 60 º sesión TOHB (0.002) y -10,96% ± 12,59 (p = 0,0004 ) post-TOHB ( Tabla 2 y Figura 3 ). El análisis de medidas repetidas muestra un efecto continuo significativo incluso después de la 30ª sesión, con un efecto dentro del grupo (F = 6,916, p = 0,018, Tabla 2 ).
HIF-1alpha
Los niveles de HIF-1 alfa aumentaron de 10,54 ± 3,39 a 19,71 ± 3,39 en la 60ª sesión (p = 0,006) donde 2 semanas después de los niveles de TOHB de 16,81 ± 7,65 no fueron significativamente diferentes de la línea de base (p = 0,16).
Discusión
En este estudio, por primera vez en humanos, se encontró que las sesiones diarias repetidas de TOHB pueden aumentar la longitud de los telómeros de PBMC en más del 20% en una población que envejece, y las células B tienen el cambio más sorprendente. Además, el TOHB disminuyó el número de células senescentes en un 10-37%, siendo las células senescentes T auxiliares las más afectadas.
Se ha observado un número sustancial de asociaciones entre la longitud de los telómeros y las modificaciones del estilo de vida. Esto ha dado lugar a varios estudios intervencionistas que incluyeron dieta, suplementos (como omega-3 y nueces, entre otros), actividad física, manejo del estrés y apoyo social. Un ensayo de dos años realizado en adultos mayores cognitivamente sanos, utilizando una dieta rica en nueces, mostró una tendencia no significativa a preservar la longitud de los telómeros en comparación con una dieta de control [ 19 ]. En otro estudio que evaluó el efecto de un entrenamiento de resistencia de tipo explosivo de baja frecuencia de doce semanas en personas mayores, la longitud de los telómeros se conservó mejor en el grupo de intervención sin un aumento significativo [ 20]. Un estudio reciente encontró que el entrenamiento de resistencia aeróbica o el entrenamiento en intervalos de alta intensidad durante seis meses aumentaron la longitud de los telómeros hasta en un 5% [ 21 ]. Las técnicas adicionales de pérdida de peso, yoga y manejo del estrés no lograron mostrar cambios significativos en la longitud de los telómeros [ 22 – 25 ]. Sin embargo, la mayoría de estos estudios han mostrado correlaciones significativas entre la actividad antioxidante y la actividad de la telomerasa [ 22 – 25 ].
Si bien muchos factores genéticos y ambientales están asociados con el acortamiento de los telómeros, el mecanismo sugerido más común es el estrés oxidativo. El estrés oxidativo puede ocurrir por desequilibrios entre la producción de especies reactivas de oxígeno (ROS) y eliminadores celulares. Los telómeros son muy sensibles al daño oxidativo del ADN, que puede inducir el acortamiento y la disfunción de los telómeros [ 26 ]. La asociación entre oxígeno y / o estrés oxidativo y la longitud de los telómeros se ha debatido durante las últimas décadas. Los estudios de cultivos de células humanas muestran consistentemente que el estrés oxidativo leve acelera el acortamiento de los telómeros, mientras que los antioxidantes y los captadores de radicales libres disminuyen las tasas de acortamiento y aumentan la vida útil proliferativa celular [ 27]. Varios estudios clínicos sobre afecciones patológicas (como diabetes, enfermedades inflamatorias, enfermedad de Parkinson) han mostrado correlaciones entre los marcadores de estrés oxidativo, los niveles de captadores de especies reactivas de oxígeno y la longitud de los telómeros [ 28 ]. Sin embargo, los individuos sanos no mostraron resultados similares [ 29 ].
La exposición de cultivos celulares a un entorno hiperbárico se ha sugerido previamente para inducir un estrés oxidativo significativo y la senescencia prematura de las células [ 30 ]. Sin embargo, esto se basó en células aisladas cultivadas en una incubadora hiperbárica y no en el complejo sistema biológico de los seres humanos como en este estudio. De manera similar al estudio actual, un estudio observacional prospectivo de un año en buzos expuestos a oxígeno hiperbárico intenso mostró un alargamiento significativo de los telómeros en los leucocitos [ 31 ]. Como se utiliza en el estudio actual, el protocolo TOHB utiliza los efectos inducidos por exposiciones hiperóxicas intermitentes repetidas, la llamada paradoja hipóxica hiperóxica [ 13 , 18]. Estas exposiciones hiperóxicas intermitentes inducen una respuesta adaptativa que incluye una mayor regulación positiva de los genes antioxidantes [ 32 ] y la producción de antioxidantes / depuradores que se ajustan a la mayor generación de ROS, lo que provoca que la relación ROS / depurador se vuelva gradualmente similar a la proporción en un entorno de oxígeno normal. Sin embargo, debido a que la vida media de eliminación de los carroñeros (T 1/2 ) es significativamente más larga que la T 1/2 de ROS, al volver a la normoxia, luego de exposiciones hiperóxicas repetidas, hay niveles significativamente más altos de carroñeros y una mayor actividad antioxidante [ 13 , 18]. Por lo tanto, de manera similar al ejercicio físico y la restricción calórica, un protocolo de TOHB repetido diariamente puede inducir el fenómeno de la hormesis. Las exposiciones únicas aumentan la generación de ROS de forma aguda, desencadenando la respuesta antioxidante y, con exposiciones repetidas, la respuesta se vuelve protectora [ 13 , 18 ].
Además, las exposiciones hiperóxicas intermitentes inducen muchas de las respuestas fisiológicas que se producen durante la hipoxia [ 13 ]. El TOHB induce la liberación de factores de transcripción denominados factores inducidos por hipoxia (HIF) y aumenta su estabilidad y actividad [ 14 ]. A su vez, el HIF induce una cascada celular que incluye el factor de crecimiento endotelial vascular y la inducción de la angiogénesis, la biogénesis de las mitocondrias, la movilización de células madre y el aumento de la actividad de SIRT1 [ 18 ]. Nuestro estudio confirma que el aumento de la expresión de HIF es inducido por exposiciones repetitivas de TOHB, que disminuye gradualmente hacia la normalización de los niveles de HIF en un entorno no monónico.
Actualmente, se han desarrollado en modelos animales muchas intervenciones que genéticamente o farmacológicamente (fármacos senolíticos) eliminan las células senescentes y están a la espera de evaluaciones de seguridad y eficacia en humanos [ 33 ]. El estudio actual sugiere un método no farmacológico, clínicamente disponible con un perfil de seguridad bien establecido, para la disminución de las poblaciones de células senescentes. Nuestro protocolo incluyó 60 sesiones de oxígeno al 100% a 2 ATA, incluidas tres pausas de aire durante cada sesión para utilizar la paradoja hipóxica hiperóxica y minimizar el riesgo de toxicidad por oxígeno. Curiosamente, tanto la TL como la reducción de células senescentes alcanzaron su punto máximo en el trigésimosesión. Sin embargo, la curva de respuesta a la dosis relacionada con la presión aplicada, el tiempo y el número de exposiciones de TOHB y su relación con la expresión de HIF y sus efectos regenerativos relacionados aún no se comprenden completamente y se necesitan más estudios para encontrar los protocolos de TOHB óptimos.
La oxigenoterapia hiperbárica es una modalidad de tratamiento bien establecida para heridas que no cicatrizan, lesiones por radiación, así como diferentes eventos hipóxicos o isquémicos (como toxicidad por monóxido de carbono, infecciones, etc.). En los últimos años, una creciente evidencia de ensayos clínicos y preclínicos demuestra la eficacia de TOHB para indicaciones neurológicas, incluida la pérdida auditiva neurosensorial súbita idiopática [ 34 ], después de un accidente cerebrovascular y una lesión cerebral postraumática [ 35 – 41 ], síndrome de sensibilización central como el síndrome de fibromialgia [ 42 , 43 ] y el deterioro cognitivo relacionado con la edad [ 17 ] y modelos animales de la enfermedad de Alzheimer [ 44]. Por primera vez, el presente estudio tuvo como objetivo evaluar el efecto fisiológico a nivel celular en humanos que envejecen sin ninguna enfermedad funcional limitante.
Limitaciones del estudio
El estudio actual tiene varias limitaciones y fortalezas a considerar. En primer lugar, debe tenerse en cuenta el tamaño limitado de la muestra. En segundo lugar, la falta de grupo de control. Sin embargo, el estudio sugiere resultados impresionantes sobre TL y aclaramiento de células senescentes, que no se observaron en otras intervenciones. Además, los valores iniciales de longitud de los telómeros de nuestra cohorte coinciden con los valores esperados para la población que envejece [ 45 – 47]. En tercer lugar, la duración del efecto aún no se ha determinado en los seguimientos a largo plazo. En cuarto lugar, la actividad de la telomerasa no se evaluó debido al método elegido para la conservación y evaluación de la sangre. No obstante, conviene destacar varios puntos fuertes. En este estudio, CD28 se utilizó como biomarcador de células senescentes, mientras que CD57 no estaba disponible como marcador confirmatorio de senescencia de células T. Los biomarcadores se evaluaron en poblaciones de leucocitos específicos en lugar de utilizar las PBMC completas como un grupo. Se midió el efecto de TOHB aislado y se controló a los participantes para que no realizaran cambios en el estilo de vida (como nutrición y ejercicio), medicamentos o cualquier otra intervención que pudiera haber actuado como posibles factores de confusión.
En resumen, el estudio indica que TOHB puede inducir efectos senolíticos significativos, incluido un aumento significativo de la longitud de los telómeros y el aclaramiento de células senescentes en poblaciones que envejecen.
Materiales y métodos
Asignaturas
Se inscribieron treinta y cinco adultos sin deterioro cognitivo patológico, de 64 años o más, que vivían independientemente en buen estado funcional y cognitivo. El estudio se realizó entre 2016 y 2020 en el Centro Médico Shamir (Assaf-Harofeh), Israel. Los pacientes incluidos no tenían antecedentes de isquemia cardíaca o cerebrovascular durante el último año antes de la inclusión. Los criterios de exclusión incluyeron: tratamiento previo con TOHB por cualquier motivo durante los últimos tres meses, cualquier historial de malignidad durante el último año, cualquier deterioro cognitivo patológico, insuficiencia renal crónica grave (TFG <30), diabetes mellitus no controlada (HbA1C> 8, ayuno). glucosa> 200), inmunosupresores, contraindicaciones de resonancia magnética (incluido IMC> 35), tabaquismo activo o enfermedades pulmonares.
Diseño del estudio
El protocolo del estudio fue aprobado por la Junta de Revisión Institucional del Centro Médico Shamir, Israel. El estudio se realizó como un ensayo clínico prospectivo. Después de firmar un consentimiento informado y someterse a una evaluación inicial, los sujetos fueron asignados a TOHB. Los puntos de medición se evaluaron al inicio, medio punto del protocolo de tratamiento ( 30ª sesión), el día de la última sesión de TOHB y 1-2 semanas después del TOHB.
La cohorte del estudio incluyó solo a pacientes tratados con TOHB, que forma parte de una cohorte más grande de población de envejecimiento normal estudiada en el centro médico Shamir, Israel (NCT02790541 [ 17 ]).
Intervenciones
El protocolo de TOHB se administró en una cámara Multiplace Starmed-2700 (HAUX, Alemania). El protocolo constaba de 60 sesiones diarias, cinco sesiones por semana dentro de un período de tres meses. Cada sesión incluyó respirar oxígeno al 100% con una máscara a 2ATA durante 90 minutos con descansos de aire de 5 minutos cada 20 minutos. Las tasas de compresión / descompresión fueron de 1 metro / minuto. Durante el ensayo, no se permitieron cambios en el estilo de vida y la dieta, ni ajustes de medicamentos.
Muestras de sangre
Se recolectaron muestras de sangre total en tubos con EDTA utilizando una técnica estándar, al inicio del estudio, en el medio punto del protocolo de TOHB ( 30a sesión), el día de la última sesión de TOHB ( 60a sesión) y 1-2 semanas después de la última sesión de TOHB.
Aislamiento de células mononucleares de sangre periférica (PBMC)
La sangre completa se diluyó usando solución salina tamponada con fosfato (PBS). La separación por gradiente de densidad se realizó utilizando tubos Leucosep llenos de Lymphoprep. A continuación, los tubos se centrifugaron a 1000 xg durante 10 min a 25 ° C grados. Después de la centrifugación, las capas celulares (capa leucocitaria) se recogieron inmediatamente con una pipeta y se transfirieron a tubos de centrífuga cónicos de 50 ml, se resuspendieron con suficiente 1X PBS hasta un volumen de 50 ml y se centrifugaron a 300 xg durante 10 min a 25 ° C grados. Después de la eliminación del sobrenadante, se etiquetó cada muestra.
Longitud del telómero
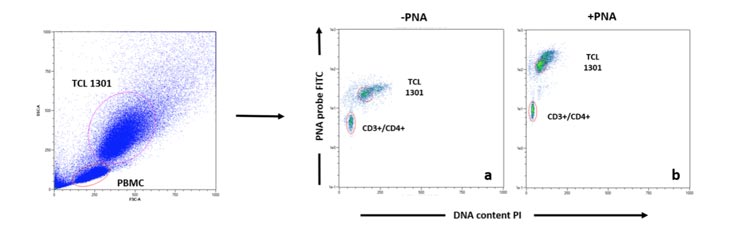
Los telómeros se marcaron de acuerdo con el protocolo del kit Dako PNA / FITC (código K5327). En una suspensión de una sola célula que consta de una mezcla de PBMC (células de muestra) y la línea celular TCL 1301 (células de control), el ADN se desnaturalizó durante 10 minutos a 82 ° C en un tubo de microcentrífuga en presencia de solución de hibridación sin sonda o en solución de hibridación que contiene la sonda de telómero de PNA conjugada con fluoresceína. La hibridación tuvo lugar en la oscuridad a temperatura ambiente (TA) durante la noche. La hibridación fue seguida de dos lavados posteriores a la hibridación de 10 minutos con una solución de lavado a 40 ° C. La muestra se marcó luego con anticuerpos conjugados CD4 +, CD8 +, CD3 +, CD19 + y CD56 + en un tampón apropiado para análisis citométrico de flujo adicional [ 48 , 49]. Cada muestra se realizó por duplicado. Después del análisis de citometría de flujo, se calculó la longitud relativa de los telómeros (RTL) para CD3 + / CD4 + (T-helper), CD3 + / CD8 + (T-citotóxico), CD3 + / CD56 + (natural killer) y CD19 + (B-cells). El valor de RTL se calculó como la relación entre la señal de telómero de cada muestra y la célula de control (línea celular TCL 1301) con corrección para el índice de ADN de las células G0 / 1. Las células de la muestra y las células de control se analizaron por separado para determinar la ploidía del ADN utilizando tinción con yoduro de propidio para estandarizar el número de extremos de telómeros por célula y, por lo tanto, la longitud de los telómeros por cromosoma. Consulte la Figura 4 para ver un ejemplo de análisis FACS.
Inmunofenotipificación
Los porcentajes de linfocitos T nulos CD3 + CD4 + CD28 (colaboradores T senescentes) y linfocitos T nulos CD3 + CD8 + CD28 (citotóxicos T senescentes) se determinaron mediante análisis de citometría de flujo. Se tiñeron PBMC con anticuerpos anti-CD3 conjugados con VioBlue, anti-CD8 conjugados con Viogreen, anti-CD4 conjugados con PE-VIO 770A y anti-CD28 APC-VIO 770A (Miltenyi Biotec). Las células se analizaron con un citómetro de flujo MACSQuant (Miltenyi Biotec). Luego se calculó el porcentaje de células T CD28 nulas dentro de la población de células T CD4 + o CD8 +.
Factor inducido por hipoxia (HIF-1alpha)
La tinción de HIF1a intracelular se realizó con anticuerpo anti-HIF1a conjugado con APC o el control de isotipo correspondiente (sistemas de I + D) después de la fijación y permeabilización (Life Technologies). Las células se analizaron con un citómetro de flujo MACSQuant (Miltenyi Biotec) y se determinó el porcentaje de PBMC que expresaban HIF1a.
análisis estadístico
A menos que se especifique lo contrario, los datos continuos se expresaron como medias ± desviación estándar. La distribución normal de todas las variables se probó mediante la prueba de Kolmogorov-Smirnov. Se realizó un ANOVA de una vía para comparar las variables entre y dentro de los tres grupos al inicio del estudio.
Los datos categóricos se expresan en números y porcentajes y se comparan mediante pruebas de chi-cuadrado. Los análisis univariados se realizaron utilizando la prueba de Chi-Cuadrado / Exacto de Fisher para identificar variables significativas (P <0.05).
Para evaluar los efectos de TOHB, se utilizó un modelo ANOVA de medidas repetidas para probar el efecto principal dentro del sujeto. Se realizaron pruebas post hoc sobre las medias para probar las diferencias de tiempo utilizando pruebas t con una corrección de Bonferroni.
Contribuciones de autor
Todos los autores contribuyeron sustancialmente a la preparación de este manuscrito. HY, HA, ES fueron responsables del diseño del protocolo. HA, ZY, BY, ES, DKM fueron responsables del reclutamiento de pacientes. YH, AHR, SM, YY, SM, ZR, ESW, HA, DKM, SG, BGR, DG, HY, AHR, FG, LE, PN, DK, FM, ZY, BY fueron los responsables de la adquisición de datos. HY, HA. y ES fueron responsables del análisis de datos. Todos los autores interpretaron los datos. HY, HA, CM y ES escribieron el manuscrito. Todos los autores revisaron y finalizaron el manuscrito.
Expresiones de gratitud
Nos gustaría agradecer al Dr. Mechael Kanovsky por la edición de este manuscrito.
Conflictos de interés
AH, BY, ZY trabajan para AVIV Scientific LTD. ES es accionista de AVIV Scientific LTD.
Fondos
El estudio fue financiado por una beca de investigación de la red Sagol para la neurociencia establecida por el Sr. Sami Sagol.
Referencias
- 1 . López-Otín C , Blasco MA , perdiz L , Serrano M , Kroemer G . Las señas de identidad del envejecimiento. Cell . 2013 ; 153 : 1194 – 217.a https://doi.org/ 10.1016 / j.cell.2013.05.039 [ PubMed ]
- 2 . Tsoukalas D , Fragkiadaki P , Docea AO , Alegakis HRISTLIKE , Sarandí es , Vakonaki es , Salataj es , Kouvidi es , Nikitovic D , Kovatsi L , Spandidos DA , Tsatsakis Pero , Calina D . Asociación de suplementos nutracéuticos con telómeros de mayor longitud. Int J Mol Med . 2019 ; 44 : 218 – 26 . https://doi.org/ 10.3892 / ijmm.2019.4191 [ PubMed ]
- 3 . Starkweather AR , Alhaeeri AA , Montpetit A , Brumelle J , Filler K , Montpetit M , Mohanraj L , Lyon DE , Jackson-Cook CK . Una revisión integradora de los factores asociados con la longitud de los telómeros y las implicaciones para la investigación bioconductual. Nurs Res . 2014 ; 63 : 36 – 50 . https://doi.org/ 10.1097 / NNR.0000000000000009 [ PubMed ]
- 4 . Puhlmann LM , Valk SL , Engert V , Bernhardt BC , Lin J , Epel ES , Vrticka P , cantante T . Asociación del cambio a corto plazo en la longitud de los telómeros de los leucocitos con el grosor cortical y los resultados del entrenamiento mental entre adultos sanos: un ensayo clínico aleatorizado. JAMA Netw Open . 2019 ; 2 : e199687 . https://doi.org/ 10.1001 / jamanetworkopen.2019.9687 [ PubMed ]
- 5 . Åström MJ , von Bonsdorff MB , Perälä MM , Salonen MK , Rantanen T , Kajantie E , Simonen M , Pohjolainen P , Haapanen MJ , Guzzardi MA , Iozzo P , Kautiainen H , Eriksson JG . Longitud de los telómeros y rendimiento físico entre las personas mayores: el estudio de cohorte de nacimiento de helsinki. Mech Aging Dev . 2019 ; 183 : 111145 . https://doi.org/ 10.1016 / j.mad.2019.111145 [ PubMed ]
- 6 . Xie Z , Jay KA , Smith DL , Zhang Y , Liu Z , Zheng J , Tian R , Li H , Blackburn EH . La inactivación temprana de la telomerasa acelera el envejecimiento independientemente de la longitud de los telómeros. Cell . 2015 ; 160 : 928 – 39 . https://doi.org/ 10.1016 / j.cell.2015.02.002 [ PubMed ]
- 7 . Goglin SE , Farzaneh-Far R , Epel ES , Lin J , Blackburn EH , Whooley MA . El cambio en la longitud de los telómeros de los leucocitos predice la mortalidad en pacientes con enfermedad coronaria estable a partir del estudio del corazón y el alma. PLoS One . 2016 ; 11 : e0160748 . https://doi.org/ 10.1371 / journal.pone.0160748 [ PubMed ]
- 8 . Armanios M . Telómeros y enfermedades relacionadas con la edad: cómo la biología de los telómeros informa los paradigmas clínicos. J Clin Invest . 2013 ; 123 : 996 – 1002 . https://doi.org/ 10.1172 / JCI66370 [ PubMed ]
- 9 . Richards JB , Valdes AM , Gardner JP , Paximadas D , Kimura M , Nessa A , Lu X , Surdulescu GL , Swaminathan R , Spector TD , Aviv A . Las concentraciones séricas más altas de vitamina D se asocian con una mayor longitud de los telómeros de los leucocitos en las mujeres. Soy J Clin Nutr . 2007 ; 86 : 1,42 mil – 25 . https://doi.org/ 10.1093 / ajcn / 86.5.1420 [ PubMed ]
- 10 . Bodnar AG , Ouellette M , Frolkis M , Holt SE , Chiu CP , Morin GB , Harley CB , Shay JW , Lichtsteiner S , Wright WE . Extensión de la vida útil mediante la introducción de telomerasa en células humanas normales. Ciencia . 1998 ; 279 : 349 – 52 . https://doi.org/ 10.1126 / science.279.5349.349 [ PubMed ]
- 11 . Townsley DM , Dumitriu B , Liu D , Biancotto A , Weinstein B , Chen C , Hardy N , Mihalek AD , Lingala S , Kim YJ , Yao J , Jones E , Gochuico BR , et al . Tratamiento con danazol para las enfermedades de los telómeros. N Engl J Med . 2016 ; 374 : 1922 – 31 . https://doi.org/ 10.1056 / NEJMoa1515319 [ PubMed ]
- 12 . Coutts F , Palmos AB , Duarte RR , de Jong S , Lewis CM , Dima D , Powell TR . La naturaleza poligénica de la longitud de los telómeros y las propiedades anti-envejecimiento del litio. Neuropsicofarmacología . 2019 ; 44 : 757 – 65 . https://doi.org/ 10.1038 / s41386-018-0289-0 [ PubMed ]
- 13 . Cimino F , Balestra C , Germonpré P , De Bels D , Tillmans F , Saija A , Speciale A , Virgili F . El oxígeno elevado pulsado induce una respuesta de tipo hipóxico en las células endoteliales umbilicales humanas y en los seres humanos. J Appl Physiol (1985) . 2012 ; 113 : 1684 – 89 . https://doi.org/ 10.1152 / japplphysiol.00922.2012 [ PubMed ]
- 14 . Sunkari VG , Lind F , Botusan IR , Kashif A , Liu ZJ , Ylä-Herttuala S , Brismar K , Velázquez O , Catrina SB . La terapia con oxígeno hiperbárico activa el factor 1 inducible por hipoxia (HIF-1), que contribuye a mejorar la cicatrización de heridas en ratones diabéticos. Regeneración de reparación de heridas . 2015 ; 23 : 98 – 103 . https://doi.org/ 10.1111 / wrr.12253 [ PubMed ]
- 15 . Milovanova TN , Bhopale VM , Sorokina EM , Moore JS , Hunt TK , Hauer-Jensen M , Velazquez OC , Thom SR . El oxígeno hiperbárico estimula el crecimiento y la diferenciación de células madre vasculogénicas in vivo. J Appl Physiol (1985) . 2009 ; 106 : 711 – 28 . https://doi.org/ 10.1152 / japplphysiol.91054.2008 [ PubMed ]
- 16 . Yang Y , Wei H , Zhou X , Zhang F , Wang C . El oxígeno hiperbárico promueve la proliferación de células madre neurales mediante la activación de la señalización del factor de crecimiento endotelial vascular / quinasa regulada por señales extracelulares después de una lesión cerebral traumática. Neuroreport . 2017 ; 28 : 1232 – 38 . https://doi.org/ 10.1097 / WNR.0000000000000901 [ PubMed ]
- 17 . Hadanny A , Daniel-Kotovsky M , Suzin G , Boussi-Gross R , Catalogna M , Dagan K , Hachmo Y , Abu Hamed R , Sasson E , Fishlev G , Lang E , Polak N , Doenyas K , et al . Mejora cognitiva de adultos mayores sanos usando oxígeno hiperbárico: un ensayo controlado aleatorio. Envejecimiento (Albany NY) . 2020 ; 12 : 13740 – 61 . https://doi.org/ 10.18632 / ageing.103571 [ PubMed ]
- 18 . Hadanny A , Efrati S . La paradoja hiperóxica-hipóxica. Biomoléculas . 2020 ; 10 : 958 . https://doi.org/ 10.3390 / biom10060958 [ PubMed ]
- 19 . Freitas-Simoes TM , Cofán M , Blasco MA , Soberón N , Foronda M , Serra-Mir M , Roth I , Valls-Pedret C , Doménech M , Ponferrada-Ariza E , Calvo C , Rajaram S , Sabaté J , et al . Consumo de nueces durante dos años y desgaste de los telómeros leucocitarios en ancianos mediterráneos: resultados de un ensayo controlado aleatorizado. Nutrientes . 2018 ; 10 : 1907 . https://doi.org/ 10.3390 / nu10121907 [ PubMed ]
- 20 . El Dimauro , venta M , Fantini C , Grazioli , Beltrán Valls MR , Mercatelli N , Parisi , Sabatini S , Louis L , Caporossi D . Entrenamiento de resistencia y homeostasis redox: correlación con los cambios genómicos asociados a la edad. Redox Biol . 2016 ; 10 : 34 – 44 . https://doi.org/ 10.1016 / j.redox.2016.09.008 [ PubMed ]
- 21 . Werner CM , Hecksteden A , Morsch A , Zundler J , Wegmann M , Kratzsch J , Thiery J , Hohl M , Bittenbring JT , Neumann F , Böhm M , Meyer T , Laufs U . Efectos diferenciales del entrenamiento de resistencia, intervalos y resistencia sobre la actividad de la telomerasa y la longitud de los telómeros en un estudio controlado aleatorizado. Eur Heart J . 2019 ; 40 : 34 – 46 . https://doi.org/ 10.1093 / eurheartj / ehy585 [ PubMed ]
- 22 . Sanft T , Usiskin I , Harrigan M , Cartmel B , Lu L , Li FY , Zhou Y , Chagpar A , Ferrucci LM , Pusztai L , Irwin ML . Ensayo controlado aleatorio de pérdida de peso versus atención habitual sobre la longitud de los telómeros en mujeres con cáncer de mama: el estudio de estilo de vida, ejercicio y nutrición (LEAN). Tratamiento para el cáncer de mama . 2018 ; 172 : 105 – 12 . https://doi.org/ 10.1007 / s10549-018-4895-7 [ PubMed ]
- 23 . Mason C , Risques RA , Xiao L , Duggan CR , Imayama I , Campbell KL , Kong A , Foster-Schubert KE , Wang CY , Alfano CM , Blackburn GL , Rabinovitch PS , McTiernan A . Efectos independientes y combinados de la pérdida de peso en la dieta y el ejercicio sobre la longitud de los telómeros de los leucocitos en mujeres posmenopáusicas. Obesidad (Silver Spring) . 2013 ; 21 : E549 – 54 . https://doi.org/ 10.1002 / oby.20509 [ PubMed ]
- 24 . Krishna BH , Keerthi GS , Kumar CK , Reddy NM . Asociación de la longitud de los telómeros de los leucocitos con el estrés oxidativo en practicantes de yoga. J Clin Diagn Res . 2015 ; 9 : CC01 – 03 . https://doi.org/ 10.7860 / JCDR / 2015 / 13076.5729 [ PubMed ]
- 25 . Tehfe M , Dowden S , Kennecke H , El-Maraghi R , Lesperance B , Couture F , Letourneau R , Liu H , Romano A . Errata para: nab-paclitaxel más gemcitabina versus gemcitabina en pacientes con adenocarcinoma de páncreas metastásico: análisis de subgrupos canadiense del ensayo de fase 3 MPACT. Adv Ther . 2017 ; 34 : 277 – 79 . https://doi.org/ 10.1007 / s12325-016-0442-2 [ PubMed ]
- 26 . Barnes RP , Fouquerel E , Opresko PL . El impacto del daño y el estrés oxidativo del ADN en la homeostasis de los telómeros. Mech Aging Dev . 2019 ; 177 : 37 – 45 . https://doi.org/ 10.1016 / j.mad.2018.03.013 [ PubMed ]
- 27 . von Zglinicki T . El estrés oxidativo acorta los telómeros. Trends Biochem Sci . 2002 ; 27 : 339 – 44 . https://doi.org/ 10.1016 / s0968-0004 (02) 02110-2 [ PubMed ]
- 28 . Sampson MJ , Winterbone MS , Hughes JC , Dozio N , Hughes DA . Acortamiento de los telómeros de los monocitos y daño oxidativo del ADN en la diabetes tipo 2. Cuidado de la diabetes . 2006 ; 29 : 283 – 89 . https://doi.org/ 10.2337 / diacare.29.02.06.dc05-1715 [ PubMed ]
- 29 . Reichert S , Stier A . ¿El estrés oxidativo acorta los telómeros in vivo? una revisión. Biol Lett . 2017 ; 13 : 20170463 . https://doi.org/ 10.1098 / rsbl.2017.0463 [ PubMed ]
- 30 . Oh S , Lee E , Lee J , Lim Y , Kim J , Woo S . Comparación de los efectos del 40% de oxígeno y dos condiciones de presión atmosférica absoluta sobre la senescencia prematura inducida por estrés de fibroblastos diploides humanos normales. Chaperones de estrés celular . 2008 ; 13 : 447 – 58 . https://doi.org/ 10.1007 / s12192-008-0041-5 [ PubMed ]
- 31 . Shlush LI , Skorecki KL , Itzkovitz S , Yehezkel S , Segev Y , Shachar H , Berkovitz R , Adir Y , Vulto I , Lansdorp PM , Selig S . Elongación de los telómeros seguida de la reducción de la longitud de los telómeros, en leucocitos de buzos expuestos a estrés oxidativo intenso, implicaciones para el envejecimiento de tejidos y organismos. Mech Aging Dev . 2011 ; 132 : 123 – 30 . https://doi.org/ 10.1016 / j.mad.2011.01.005 [ PubMed ]
- 32 . Godman CA , Joshi R , Giardina C , Perdrizet G , Hightower LE . El tratamiento con oxígeno hiperbárico induce la expresión de genes antioxidantes. Ann NY Acad Sci . 2010 ; 1197 : 178 – 83 . https://doi.org/ 10.1111 / j.1749-6632.2009.05393.x [ PubMed ]
- 33 . Pignolo RJ , Passos JF , Khosla S , Tchkonia T , Kirkland JL . Reducir la carga de células senescentes en el envejecimiento y las enfermedades. Tendencias Mol Med . 2020 ; 26 : 630 – 38 . https://doi.org/ 10.1016 / j.molmed.2020.03.005 [ PubMed ]
- 34 . LE W . Indicaciones de la terapia de oxígeno hiperbárico. UHMS . 2008 ; 12ª edición: 215 – 218 .
- 35 . Boussi-Gross R , Golan H , Fishlev G , Bechor Y , Volkov O , Bergan J , Friedman M , Hoofien D , Shlamkovitch N , Ben-Jacob E , Efrati S . La oxigenoterapia hiperbárica puede mejorar el síndrome posconmoción cerebral años después de una lesión cerebral traumática leve: ensayo prospectivo aleatorizado. PLoS One . 2013 ; 8 : e79995 . https://doi.org/ 10.1371 / journal.pone.0079995 [ PubMed ]
- 36 . Efrati S , Fishlev G , Bechor Y , Volkov O , Bergan J , Kliakhandler K , Kamiager I , Gal N , Friedman M , Ben-Jacob E , Golan H . El oxígeno hiperbárico induce neuroplasticidad tardía en pacientes que han sufrido un accidente cerebrovascular: ensayo prospectivo aleatorizado. PLoS One . 2013 ; 8 : e53716 . https://doi.org/ 10.1371 / journal.pone.0053716 [ PubMed ]
- 37 . Mukherjee A , de Raison M , Sahni T , Arya A , Lambert J , Marois P , James PB , un padre , Ballaz L . Rehabilitación intensiva combinada con terapia con HBO2 en niños con parálisis cerebral: un estudio longitudinal controlado. Submarino Hyperb Med . 2014 ; 41 : 77 – 85 . [ PubMed ]
- 38 . Hadanny A , Golan H , Fishlev G , Bechor Y , Volkov O , Suzin G , Ben-Jacob E , Efrati S . El oxígeno hiperbárico puede inducir neuroplasticidad y mejorar las funciones cognitivas de los pacientes que sufren daño cerebral anóxico. Restor Neurol Neurosci . 2015 ; 33 : 471 – 86 . https://doi.org/ 10.3233 / RNN-150517 [ PubMed ]
- 39 . Tal S , Hadanny A , Berkovitz N , Sasson E , Ben-Jacob E , Efrati S . El oxígeno hiperbárico puede inducir angiogénesis en pacientes que padecen un síndrome posconmocional prolongado debido a una lesión cerebral traumática. Restor Neurol Neurosci . 2015 ; 33 : 943 – 51 . https://doi.org/ 10.3233 / RNN-150585 [ PubMed ]
- 40 . Hadanny A , Rittblat M , Bitterman M , May-Raz I , Suzin G , Boussi-Gross R , Zemel Y , Bechor Y , Catalogna M , Efrati S . La terapia con oxígeno hiperbárico mejora las funciones neurocognitivas de los pacientes que han sufrido un accidente cerebrovascular: un análisis retrospectivo. Restor Neurol Neurosci . 2020 ; 38 : 93 – 107 . https://doi.org/ 10.3233 / RNN-190959 [ PubMed ]
- 41 . Tal S , Hadanny A , Sasson E , Suzin G , Efrati S . La terapia con oxígeno hiperbárico puede inducir angiogénesis y regeneración de fibras nerviosas en pacientes con lesión cerebral traumática. Frente Hum Neurosci . 2017 ; 11 : 508 . https://doi.org/ 10.3389 / fnhum.2017.00508 [ PubMed ]
- 42 . Efrati S , Golan H , Bechor Y , Faran Y , Daphna-Tecoa S , Sekler G , Fishlev G , Ablin JN , Bergan J , Volkov O , Friedman M , Ben-Jacob E , Buskila D . La terapia con oxígeno hiperbárico puede disminuir el síndrome de fibromialgia: ensayo clínico prospectivo. PLoS One . 2015 ; 10 : e0127012 . https://doi.org/ 10.1371 / journal.pone.0127012 [ PubMed ]
- 43 . Hadanny A , Bechor Y , Catalogna M , Daphna-Tecoa S , Sigal T , Cohenpour M , Lev Wiesel-R , Efrati S . La terapia con oxígeno hiperbárico puede inducir neuroplasticidad y una mejora clínica significativa en pacientes que padecen fibromialgia con antecedentes de abuso sexual infantil, ensayo controlado aleatorio. Psicol delantero . 2018 ; 9 : 2495 . https://doi.org/ 10.3389 / fpsyg.2018.02495 [ PubMed ]
- 44 . Shapira R , Efrati S , Ashery U . La oxigenoterapia hiperbárica como un nuevo enfoque de tratamiento para la enfermedad de Alzheimer. Neural Regen Res . 2018 ; 13 : 817 – 18 . https://doi.org/ 10.4103 / 1673-5374.232475 [ PubMed ]
- 45 . Steenstrup T , Kark JD , Verhulst S , Thinggaard M , Hjelmborg JV , Dalgård C , Kyvik KO , Christiansen L , Mangino M , Spector TD , Petersen I , Kimura M , Benetos A , et al . Telómeros y el límite natural de la vida útil de los seres humanos. Envejecimiento (Albany NY) . 2017 ; 9 : 1130 – 42 . https://doi.org/ 10.18632 / ageing.101216 [ PubMed ]
- 46 . Shammas MA . Telómeros, estilo de vida, cáncer y envejecimiento. Curr Opin Clin Nutr Metab Care . 2011 ; 14 : 28 – 34 . https://doi.org/ 10.1097 / MCO.0b013e32834121b1 [ PubMed ]
- 47 . I Teubel , Elchinov Y , Roura S , Fernandez MA , Galvez Stack-C , Miller P , Antonio M , Lupón J , Bayes-Genis A . Desgaste de los telómeros en la insuficiencia cardíaca: un análisis longitudinal de flujo-FISH de los monocitos circulantes. J Transl Med . 2018 ; 16 : 35 . https://doi.org/ 10.1186 / s12967-018-1412-z [ PubMed ]
- 48 . Baerlocher GM , Lansdorp PM . Mediciones de la longitud de los telómeros en subconjuntos de leucocitos mediante FISH de flujo multicolor automatizado. Una citometría . 2003 ; 55 : 1 – 6 . https://doi.org/ 10.1002 / cyto.a.10064 [ PubMed ]
- 49 . Baerlocher GM , Lansdorp PM . Mediciones de la longitud de los telómeros mediante hibridación in situ de fluorescencia y citometría de flujo. Métodos Cell Biol . 2004 ; 75 : 719 – 50 . https://doi.org/ 10.1016 / s0091-679x (04) 75031-1 [ PubMed ]